初期進化における核酸様補酵素の役割
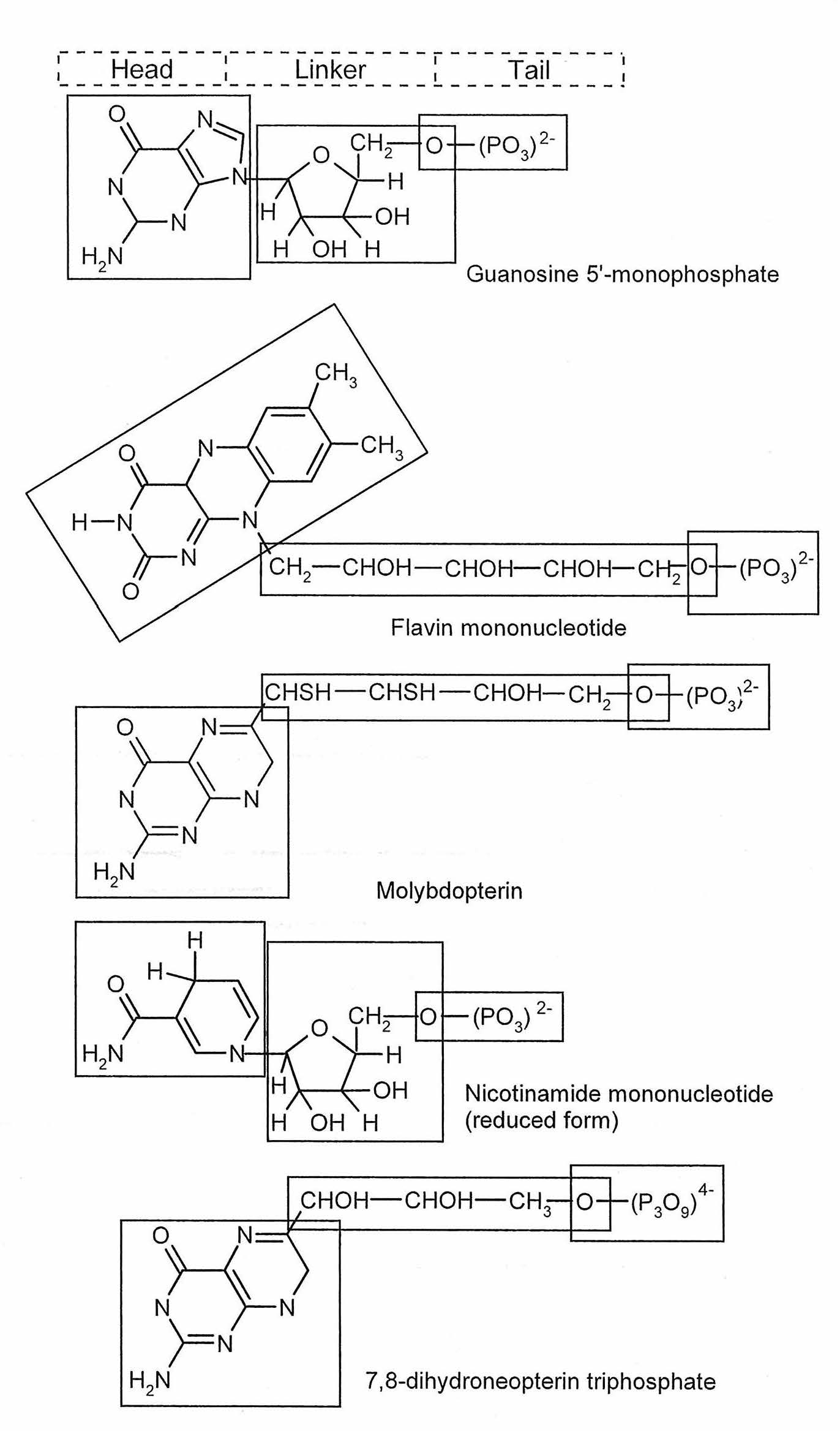
すべてのリボヌクレオチドもしくはヌクレオシド二/三リン酸は補酵素として、そしてアミノアシル基、リン酸基、グリコシル基、リン脂質前駆体のキャリアとして様々な代謝反応に関与している。Kritsky and Telegina 2004は、ヌクレオチドに似ているが少し違う化合物が補酵素として様々な代謝経路で働いていることを指摘している。それらは、ヌクレオチドと同様に、正に帯電した複素環を持つ「頭」、中性の首、さらに負に帯電した尾が結合した構造をしていることを指摘している(図1)。これらには、フラビンモノヌクレオチド(FMN)、モリブドプテリン、ピリドキサール燐酸、チアミン二燐酸(TDP)、6,7-ジヒドロネオプテリン三燐酸(ビオプテリンの前駆体)、そして、ニコチン酸アミド一燐酸などがある。
ニコチン酸アミドとピリドキサール補酵素では、正に帯電した「頭」はピリミジン環であり、チアミン二燐酸補酵素では「頭」はチアゾール環と共役したピリミジン環である。FMNと他のフラビン類は複素環を持っている。プテリン補酵素は、ビオプテリンとモリブドプテリンや葉酸と同様、複環式塩基としてプテリンを持っている。
「首」は、NMN+とFMNの場合はリボースもしくはリビトールであり、チアミン二燐酸とピリドキサール燐酸の場合は、短い脂肪族鎖である。ビオプテリンのようなプテリンでは、水酸化された脂肪鎖構造が「首」に当たっている。モリブドプテリンでは、チオール化、水酸化されたブタン鎖が「頭」と燐酸基の「尾」をつないでいる。もっとも複雑な補酵素である葉酸では、プテリジン基が負に帯電したグルタミルもしくはオリゴグルタミルの「尾」をp-アミノ安息香酸(PAB)がつないでいる。
ニコチン酸アミドアデニンジヌクレオチド(NAD+)、ニコチン酸アデニンジヌクレチド3′-燐酸、フラビンアデニンジヌクレオチド(FAD)、そしてモリブドプテリンを含むジヌクレオチドは、一つの補酵素が、普通のリボ核酸と結合したもので、ジヌクレオチドに準ずるものである。また、これらの補酵素は、RNA合成酵素などの働きで、RNAの端に共有結合されることがある。
ヌクレオチド様補酵素は、そのアポ酵素の中で、普通はあまり反応性が高くないが、光で励起されるとその反応性が高くなり、非常に多くの反応に参加するようになる。核酸塩基が吸収する250-280nmの紫外線の他に、フラビン、プテリンそして還元型ニコチン酸アミドは、300-400nmの紫外線を吸収する。フラビンはさらに、500nm付近の短波長可視光で励起される。励起された補酵素の一重項状態は、効率よく三重項状態に変換される。後者は、溶液中で他の分子と相互作用するので、前生物学的な化学の観点からより興味深い。フラビンとプテリンの三重項の寿命は0.1-1.0秒にまで達する。
フラビンの中間酸化還元電位E’0はー0.22Vでありかなり強い還元剤としてふるまう。しかし、三重項状態に遷移したフラビンは、対応する酸化還元電位が+1.85Vに移る。つまり非常に求電的な性質を持ち、様々なかなり高い酸化還元電位を持っている物質からも電子を引き抜ける。そのような反応は孤立ラジカル機構を含んでおり、反応性の高い代謝的生産物を形成する。それらは、ジヒドロフラビンやジヒドロプテリンもしくはテトラヒドロプテリンである。テトラヒドロプテリンは強い還元剤(E’0=-0.5V)で、光子によって励起された三重項状態では、さらに電子に2.50eVのエネルギーを獲得する。
Fe3+-チトクロームbのような電子受容体の存在下で、励起されたフラビンとプテリンは電子供与体から受容体への電子の受け渡しを触媒する。人工の脂質膜に埋め込まれた親油性リボフラビン派生物は、酸化還元透過物の膜を通した輸送を光を使って行う。
還元された分子の光化学は酸化型の補酵素と違う。励起されたジヒドロプテリンは、電子受容体として機能し、テトラヒドロ形に変わる。還元型のジヒドロフラビン分子の励起された一重項状態は、DNAフォトリアーゼの中で、電子の供与体として働く。励起されたNADHとNADPHは強い還元剤として働く。無酸素化で、それらはフェロドキシンとメチルビオロゲンを還元する。非励起ニコチン酸アミドの酸化還元電位は、-0.32Vでフェロドキシンのそれは-0.43Vであり、メチルビオロゲンの還元の結果できるジヒドロピリジルのそれは-0.79Vである。つまり、還元型ニコチンアミドは光を使って上向き電子移動を行っている。
フラビンとプテリン補酵素は、生物の紫外線(UV-AとUV-B)および短波長可視光に対する生理学的反応を仲介する広い範囲の光子受容体の発色団として働いている。還元型のニコチンアミド補酵素は、ヒドロゲナーゼのような酵素の活動度を制御している。補酵素が結合した光センサーは構造的に異なった、4つの遺伝子族を構成している。最初のグループは、DNA光修復酵素で、UVで損傷を受けた核酸分子の修復を行う。隣り合った(ほとんどはピリミジン)塩基のくっついて二量体となってしまったシクロブタンを光のエネルギーを使って引き離す。その遺伝的相同体であるクリプトクロムは、植物と動物の発達を媒介する色素である。これらのタンパク分子は二つの発色団を含んでいる。最初の発色団は、酵素の活性中心に位置している還元型FAD(FADH2)で、もう一つは光捕獲体である5,10-N-メチール-テトラヒドロ葉酸(MTHF)である。
第二のグループは、菌類の発生を支配するWhite Collar 1(WC-1)感光体や、植物の光制御体フォトトロピンのである。これらはFMNと結合するPASとLOV領域を持っている。フォトトロピンでは、イソアロキサジンの4位の炭素原子のLOV部のシステイン残基の一つへの付加反応への励起FMNの発色団としての関与が示されている。この付加反応が、タンパク質の構造変化を引き起こしている。これらのペプチド鎖は、励起フラビンが駆動する反応で制御されており酸化還元検出タンパクに起源していると考えられる。
第三のグループはLOV(PAS)部位を含むタンパクと同様に、真核生物の硝酸塩還元酵素は、FAD発色団の光化学励起によって制御されている。
最近になって発見された第4のグループは光によって活性化されるFMNを含んだアデニリルシクラーゼである。
これらの4つのグループには、基本構造に共通性がないので同一系統とは思えない。独立に多系統として成立したと考えられる。
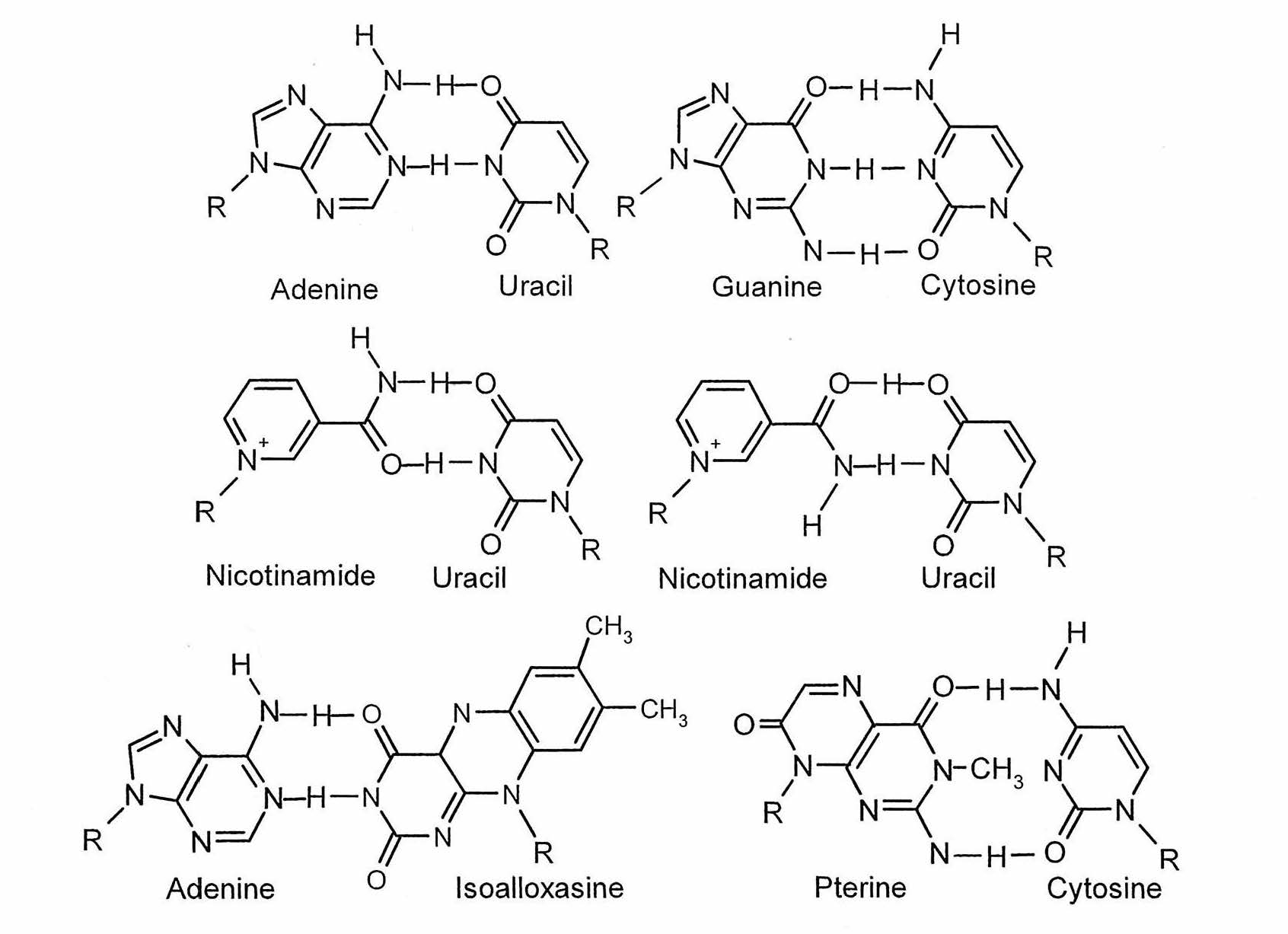
プテリジン塩基はプリン塩基と構造が似ていて核酸の構造に取り込まれたときは、対合する塩基と水素結合を形成する。また、フラビンのケトン基とニコチン酸アミドのアミノ基も核酸塩基と対合して水素結合を形成することが報告されている(図2)。生物の誕生時に最初に成立したと考えられるRNAワールドでは、これらの補酵素もRNAの一部として取り込まれRNAの酵素活性の多様化に寄与していた可能性がある。
Kritsky, M.S. and Telegina, T.A., 2004, Role of Nucleotude-like
coenzimes in primitive Evolution, In Origions: genesis, evolution, and diversity of life, edited by Seckbach, J. Springer, 215-230.
書籍版『科学はひとつ』のご案内
戎崎俊一 著
学而図書/四六判 並製320頁/本体2,400円+税
12年にわたり執筆されてきた記事を精選し、「地震と津波防災」など全9章に再編。すべての章に著者書き下ろしの解説を加えて集成した一冊。