リボフラビン生合成経路:Biosynthesis pathway for riboflavin
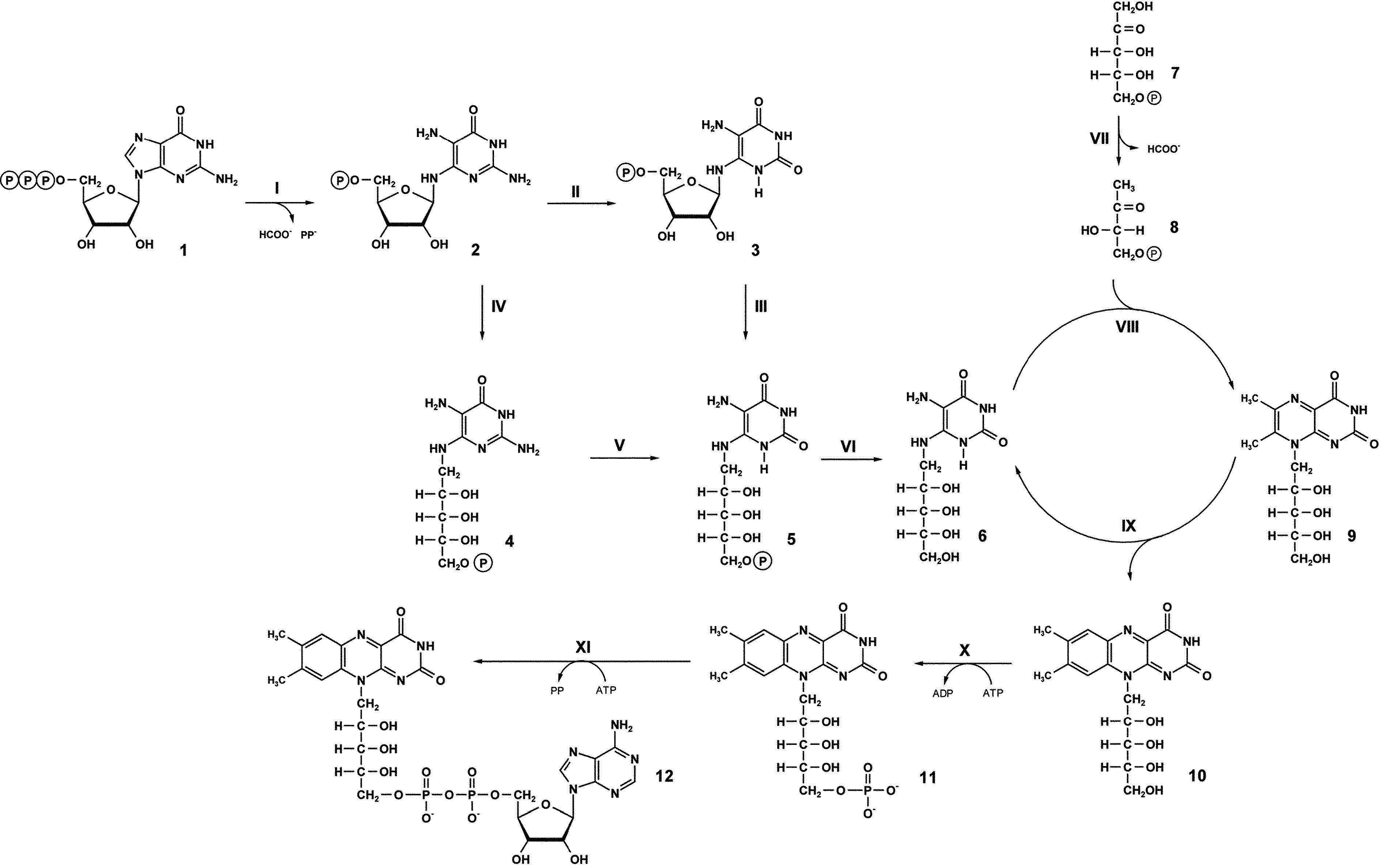
リボフラビンの生合成経路は図1にまとめられているように、1分子のGTPと二分子のリボース5リン酸から始まる(Fischer and Bacher 2005)。GTPシクロヒドロラーゼIIが、アミダゾール環からギ酸、GTP(1)の側鎖から二リン酸を放出して、2,5-ジアミノ-6-リボシルアミノ-4(3H)-ピリミジノーネ5′-リン酸(2)を生成する。2位のアミノ基の水分解性放出とリボース側鎖の還元、そしてリン酸の脱離により5-アミノ-6-リビチルアミノ-2,4(1H,3H)-ピリミジンジオーネ(3)を作る。ピリミジン派生物(6)は、3,4-ジヒドロキシ-2-ブタノン-4-リン酸(8)と縮合して、6,7-ジメチル-8-リビチル-ルマジン(9)となり、最終的な産物のリボフラビン(10)となる。
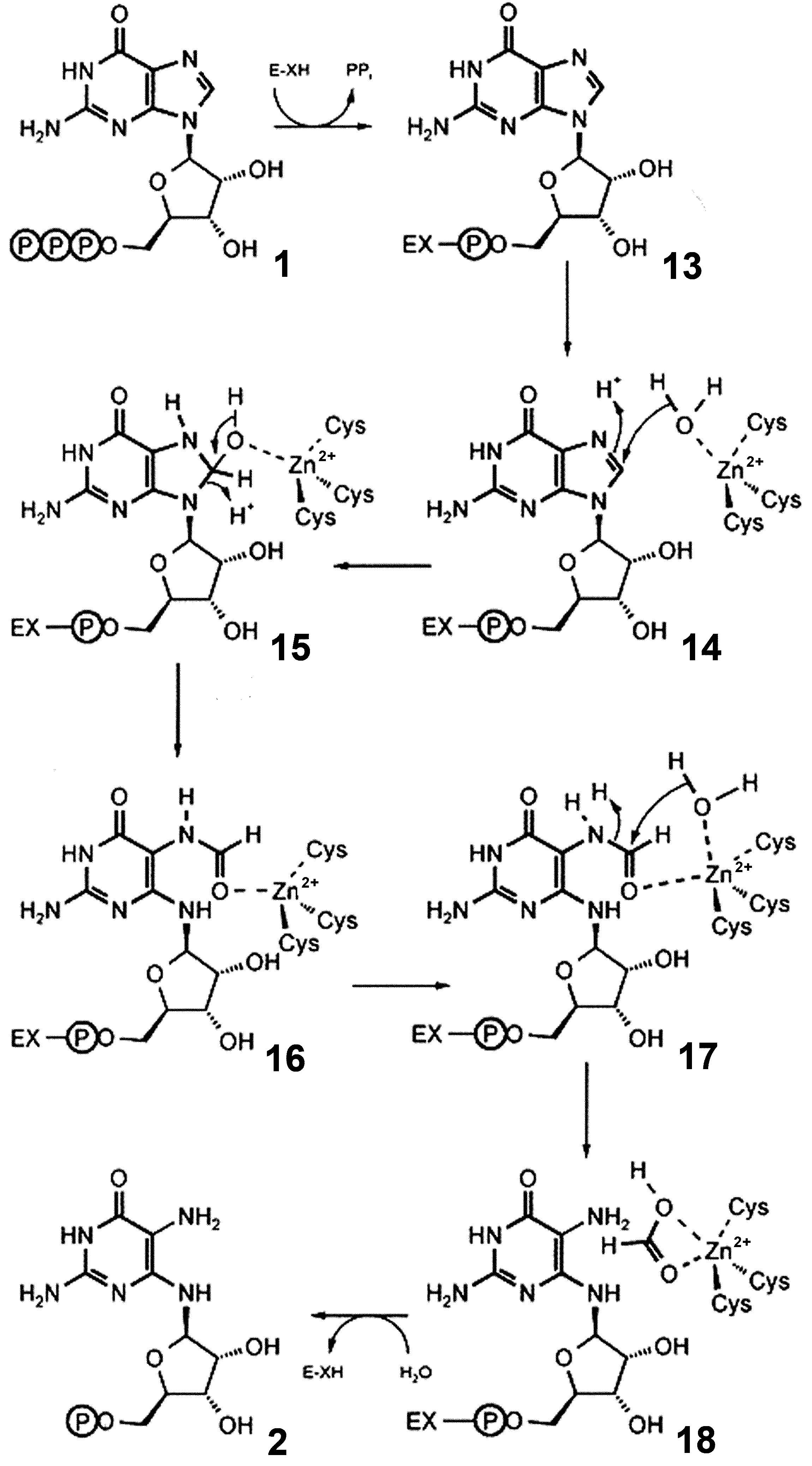
GTPシクロヒドロラーゼIIはGTPを2,5-ジアミノ-6-リボシルアミノ-4(3H)-ピリミジノーネ5′-リン酸(2)とギ酸、無機ピロリン酸に変換する。その反応機構は、まず、ピロリン酸の放出に際して、二つの炭素‐窒素結合が切断されてギ酸が作られ、イミダゾール環が開いてピリミジンが作られる(2)。この酵素は、サブユニットごとに1個の亜鉛イオンを含んでいる。それに配位するシステイン残基(Cys54、Cys65、cys67)を置き換えると、触媒活性が消失し、亜鉛イオンが結合しなくなる。その三次元構造はまだ決まっていないが、亜鉛の関与が強く示唆されている。
一方で、GTPシクロヒドロラーゼIは、テトラヒドロ葉酸とテトラヒドロプテリンの生合成経路の最初に現れる酵素である。それは、GTPシクロヒドロラーゼIIと同様に、亜鉛イオンが二つのチオール基(Cys110とCys181)および一つのヒスジチン(Hys113)にキレートされており、二つの炭素・窒素結合の加水開裂とその結果としてのギ酸の放出に必須である。もう一つのヒスチジン(His112)がさらに、水分子を介して接触している。このGTPシクロヒドロラーゼIIの三次元構造はまだわかっていないが、GTPシクロヒドロラーゼIの三次元構造はすでに決められており、ホモダイマーを形成していることが分かっている。
植物と多くの真正細菌は、GTPシクロヒドロラーゼII領域と3,4ジヒドロキシ-2-ブタノン4リン酸合成酵素が融合したタンパク質を持っている。この融合酵素がリボフラビン合成経路の最初の部分を担っている。
Fischer, M. and Bacher A. 2005, Biosynthesis of flavocoenzymes, Nat. Prod. Rep., 22, 324-350.
書籍版『科学はひとつ』のご案内
戎崎俊一 著
学而図書/四六判 並製320頁/本体2,400円+税
12年にわたり執筆されてきた記事を精選し、「地震と津波防災」など全9章に再編。すべての章に著者書き下ろしの解説を加えて集成した一冊。