細胞内輸送システムと真核生物の共通祖先: Intracellular Transportation System and Last Common Eukaryote Ancestor
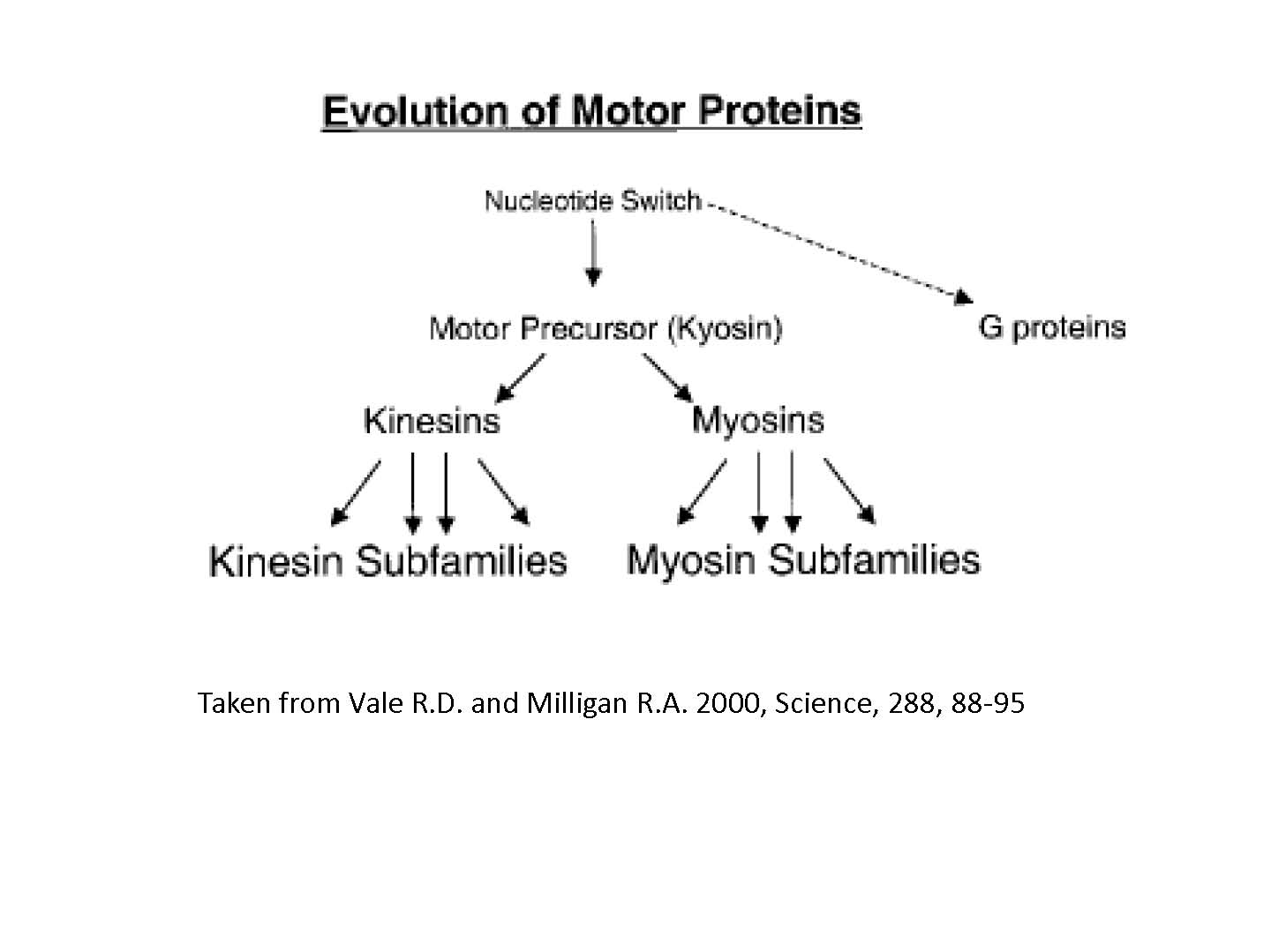
図1:モータータンパクは核酸スイッチに起源をもちGタンパクと同根である(Vale R.D. and Milligan R.A. 2000, Science, 288, 88-95)
Erickson et al. 2007にしたがって、細胞内輸送システムに関連する遺伝子の進化について議論する。真核生物の細胞内輸送は、レール繊維とその上を動くモーターで成り立っている。レール繊維は、主にチューブリンとアクチンが使われている。前者は細胞分裂に、後者はその他の細胞内物質輸送に使われている。
モーター分子は、いろいろあるがここではキネシン(主にチューブリンの上を動く)とミオシン(主にアクチンの上を動く)について議論する。ATPの解離エネルギーを使って、レール繊維の上を一歩一歩移動する。モーター分子は、種によって、用途によって少しづつ配列が違ったものが数千種類報告されているが、すべて同起源であるとされている。遺伝子重複によって数が増えたと考えられている。
まず、モーター分子は、核酸スイッチに起源をもつようだ。核酸スイッチの一つにGタンパクといわれる一群のタンパク質分子は、細胞内でスイッチの役割を果たしている。マグネシウムを一つ持ち、GTP(グアノシン三リン酸)を分解するかどうかで、その後のタンパク質の代謝を制御して、細胞の制御に使われている。細胞分裂の開始や、アポトーシス(自殺)の開始だとかの重要な判断の分岐には必ずこのGタンパクがいて、制御している。高エネルギー物質であるGTPを使うので熱揺らぎによらず安全確実な制御ができる。モーター分子がこのような重要なタンパク質群と類縁関係にあるのは印象的である。進化的には、まず核酸スイッチが獲得され、遺伝子重複でGタンパクと最初のモーター分子(KinesinとMyosinの共通祖先なので図1ではKyosinとしている)が分岐した。それがさらに遺伝子重複で別れていったと考えられる。
Wickstead et al (2010)は45種の真核生物のキネシン・スーパーファミリーに属する1642個のキネシンの類縁関係を調べた。その結果、これらが51個の群れ(ファミリー)に分離することがわかった。その中で、真核生物にほぼ共通に存在する11個のキネシンファミリーを特定した。つまり、真核生物の共通祖先は少なくとも11個のキネシンを持っていて、キネシン/チューブリン輸送システム(つまり有糸分裂システム)はすでにかなり発達していたことを意味している。
一方、328種の真核生物の2269種のミオシンのスーパファミリーの類縁関係をOdronitz and Kollmar 2007が調べている。その結果は、真核生物の誕生のときは1種類のミオシン(ミオシン5:これだけが全真核生物に共通だった)を持っていて、その後、遺伝子複製を繰り返して種類が増え、今は十数個のミオシンファミリーが存在している。特に注目するのが、菌類(Fungi)/後生生物(Metazoa)の共通祖先が分岐するときと菌類と後生生物が分岐するときで10個のミオシンが獲得されて2倍増している。
次に、レール繊維について考える。これまでアクチンとチューブリンの起源になりそうな遺伝子配列が似た分子が、より原始的な細菌や古細菌で見つからずに論争になっていた。ところが、より精度の高い比較を行った結果、類似度が有意にある分子が見つかった。まず、チューブリンは、FtsZと同起源であると推定された。
FtsZは、黒岩氏が葉緑体の分裂機構として見つけたもので、細菌や古細菌に普遍的に存在する。配列と構造が似ている上に、FtsZがある条件でつながって、チューブリンとよく似た繊維を作ることがわかってきました。Davis 2002は、FtsZの起源は非常に古いのではないかと推察している。というのは、FtsZでは、アルギニン、リジン、フェニルアラニン、トリプトファンがほとんどなく、これらの遺伝子コードが確立する前に獲得された遺伝子であるようだからである。生物にとって細胞分裂は最初に獲得した機能だかから、それに必須のFtsZの起源か古いのは納得できる。FtsZ遺伝子が遺伝子複製によって二つになり、一方が別の機能(この場合は、キネシン用のレール繊維の機能)を持って進化してチューブリンになった。真核生物は最初はFtsZで細胞分裂していたが、より効率の良いチューブリンを使う有糸分裂システムに順次置き換わり、最終的にはFtsZ遺伝子は喪失されたと考えられる。レール繊維としての機能確立ののちは、その上を動くキネシンと共進化を遂げて真核生物の中でよく保存された遺伝子配列を持つことになった。このことは、真核生物の共通祖先が11種類のキネシンをすでに発達させていたとつじつまが合っている。
次に、アクチンの原核生物対応の遺伝子は、細菌のMreBである。その機能はわからないことが多いが、細胞の形を整える働きをしているといわれている。このタンパクがやはりアクチンによく似た繊維を作ることが確認されました。また、これら二つはsugar kinese (糖を燐酸化して活性化する)遺伝子とも高い類似度を持っており。したがって、まず、糖の代謝に関係するsugar kinaseが獲得され、それが遺伝子の複製でMreBが作られて細胞の形を整える機能を持ち、さらに遺伝子の複製でレール繊維としての機能を持ったとするのが自然のようである。レール繊維としての機能確立ののちは、ミオシンと共進化を遂げて真核生物の中でよく保存された遺伝子配列を持つことになったと考えられる。
アクチンは、その分子が集合して繊維化することだけで力を生み出せるようだ(Pollard et al. 2000)。最初の真核生物はこれを使って移動し、周りにいる細菌を包み込んで捕食する能力を持った最初の肉食生物だった可能性が高い。それと前後して、キネシンの遺伝子複製か、Gタンパク遺伝子からの独立進化でミオシンが獲得され、より効率的に細胞の形を動かせるようになったのだろう。捕食能力によって、αプロテオ細菌やシアノバクテリアを体内に取り込んで共生するようになり、真核生物が確立したと考えられる。
共生初期は、細胞内の遺伝子発現のイニシアチブの取り合いでし烈な戦いがあったはず(共生体が暴走すれば、感染・発症・死亡となる)ですが、効率的な有糸分裂システムと遺伝子調節メカニズムをあらかじめ発達させていた最初の真核生物はその戦いを制し、共生体の奴隷化と遺伝子の収奪に成功したのだろう。
Davis B.K., 2002, Prog. Biophys. Mol. Biol. 79, 77–133.
Erickson、H.P., 2007, BioEssay, 29, 668-677.
Odronitz, F. and Kollmar M., 2007, Genome Biology, 8, R196.
Pollard, T.D. et al. 2000, Annu. Rev. Biophys. Biomol. Struct., 29, 545–76.
Wickstead, W. et al, 2010, BMC Evolutionary Biology, 10, 110
書籍版『科学はひとつ』のご案内
戎崎俊一 著
学而図書/四六判 並製320頁/本体2,400円+税
12年にわたり執筆されてきた記事を精選し、「地震と津波防災」など全9章に再編。すべての章に著者書き下ろしの解説を加えて集成した一冊。