ヒドロゲナーゼの構造と分類: Structure and clasification of Hidrogenazes
ヒドロゲナーゼ(H2ase)は水素分子の酸化反応と逆反応を触媒する酵素で、生体のエネルギー代謝で中心的な役割をはたす。この酵素は、古細菌と細菌にひろくみられ、真核細胞にもみられる。ほとんど大部分のH2aseは金属酵素でありその金属部位は、二つの種類に分けられる。最初の種類は古典的な[2Fe-2S]、[2Fe-4S]、そして[4Fe-4S]でできた鉄・硫黄クラスタである。これらの金属クラスタは、H2活性サイトとH2aseの酸化還元パートナーとの間の電子を輸送を行っている。もう一種類の金属部位は、NiとFe([NiFe])ともしくはFe2二つ([Fe])でできた二核金属サイトである。Vignais et al. (2001)によると、配列および三次元構造の詳細な比較により、これらのH2aseは、[NiFe]を持つか、[Fe]を持つかにより、[Fe]-H2ase、[NiFe]-H2aseに分類でき、両者は、はっきり違った進化系統であることが分かった。[Fe]-H2aseは細菌と真核生物にだけ存在し、[NiFe]-H2aseは、一つの例外を除いて古細菌と細菌にしか存在しない。また、[NiFe]-H2aseの成熟に必要なたんぱく質の配列は、[Fe]-H2aseを持つ生物には見つからない。この事実は両者が、系統的にはっきり分かれていることと整合的である。
[NiFe]-H2aseの反応中心は、αβヘテロダイマーである。この二つのサブユニットは大きな面積で接触し、全体として球状である。NiFe反応中心は、大きなサブユニットの中に深く埋め込まれている。Feには三個のCO/CN分子が配位し、システインからの二つの硫黄がNiとの間を架橋している。さらに3つのシステイン由来の硫黄がNiを取り囲んでいる(Boeck etal 2006)。一方、小さなサブユニットは、3つのFe-Sクラスタを持つ。これらは、H2反応中心と電子受容体もしくは電子供与体との間の電子輸送を担っている。このFe-Sクラスタは、[NiFe]-H2aseにおけるH2の活性化に必須である。疎水性の回廊がサブユニットを貫いて表面と活性中心と表面との間をつないでいる。系統樹解析は、二つのサブユニットは共進化したことを示している。
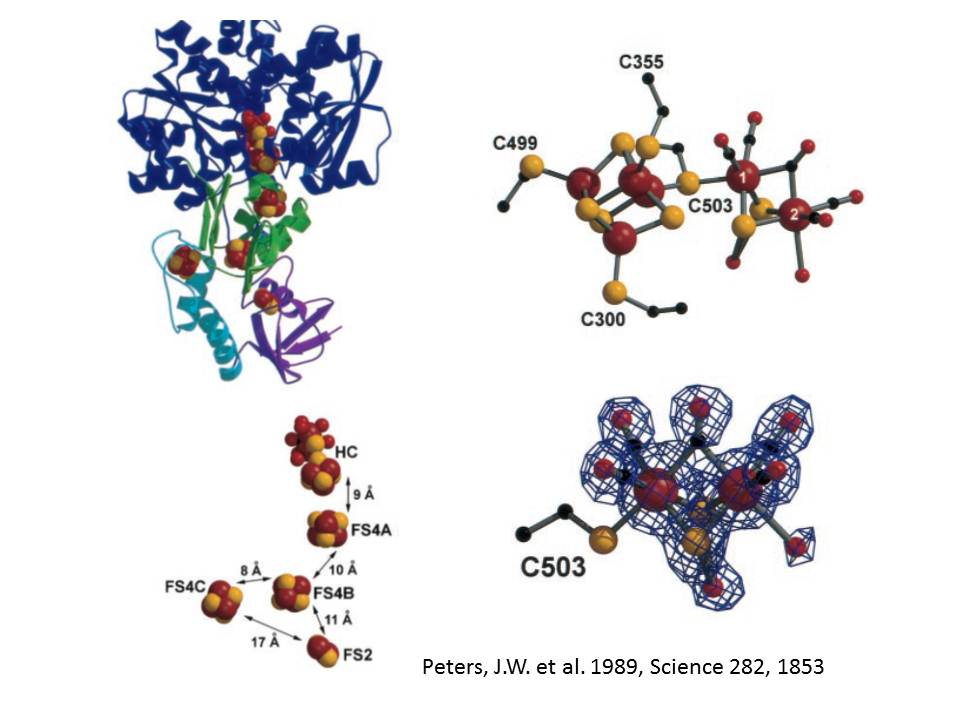
次に、[Fe]-H2aseの反応中心はHクラスタと呼ばれている。Hクラスタにおいては、二個の鉄原子の周りに5個のCN/CO分子が配位している。さらに3つの[4Fe-4S]クラスタと一つの[2Fe-2S]クラスタがたんぱく質内にあり、それぞれシステインの硫黄で架橋されている(Peters et al. 1998; Nicolet et al. 1999)。活性中心を取り囲む残基のいくつかは、H2とH+が通過する活性中心と表面をつなぐ回廊として機能しているかもしれない。
実際、アミノ酸配列の比較により、H2aseは、他の酸化還元たんぱく質/酵素と関係を持っていることが分かってきた。H2aseのFe-Sクラスタを含む部分は溶融性のフェロドキシンとの間に高い類似性がある。また、呼吸電子伝達鎖複合体、特にNADHユビキノン酸化還元酵素(Complex I)のなかに対応する類似構造がある。このことは、アルカリ熱水孔近くで、まずフェロドトキシンのような水溶性酸化還元酵素が発達し、それらを取り込んで、多種類のH2aseができたと考えられる。また、全体として電子伝達系を効率化するために、複数のH2aseが細胞膜上でさらに結合して、Complex Iなどの電子伝達鎖複合体ができたと考えられる。
Fe、Ni、S、CO、そしてCNは、アルカリ熱水孔で普遍的にみられる元素もしくは分子である。これらでH2aseの活性部位を構成されているのは、生命のエネルギー代謝システムが、アルカリ熱水孔で進化・発達した時の名残なのかもしれない。
また、[FeNi]H2aseと[Fe]H2aseの二つの違った進化系統のヒドロゲナーゼが存在することは、地球におけるアルカリ熱水孔の進化と関係があるかもしれない。
Vignais, P.M. et al. 2001, Clasification and phylogeny of hydrogenazes, FEMS Microbiology, 25, 455-501.
Bock, A. et al. 2006, Matuarization of Hydrogenazes, Advances in Microbial Physiology, 51, 1-72.
Peters, J.W. et al. 1998, X-ray Crystal Structure of the Fe-Only Hydrogenase (CpI) from Clostridium pasteurianum to 1.8 Angstrom Resolution, Science 282, 1853-1858.
Nicolet, Y. 1999, Desulfovibrio desulfuricans iron hydrogenase: the structure shows unusual coordination to an active site Fe binuclear center, Structure January 1999, 7,
13-23.
書籍版『科学はひとつ』のご案内
戎崎俊一 著
学而図書/四六判 並製320頁/本体2,400円+税
12年にわたり執筆されてきた記事を精選し、「地震と津波防災」など全9章に再編。すべての章に著者書き下ろしの解説を加えて集成した一冊。