ビタミンCの多面的な役割: Many Faces of Vitamin C
ビタミンC(アスコルビン酸)は、スーパーオキシド(O2-)、ヒドロキシラジカル(・OH)、過酸化水素(H2O2)などの活性酸素類を消去する。ビタミンCが酸化されて、電子を失うとアスコルビン酸ラジカルになる。これは共鳴のために電子が非局所化され、ラジカルとしては比較的安全である。アスコルビン酸ラジカルがもう一つ電子を失う(酸化する)と、デヒドロアスコルビン酸となり、分解され体外に排出されるが、その前にグルタチオンからの電子二個を得れば、ビタミンCにもどる(グルタチオン-アスコルビン酸回路)。
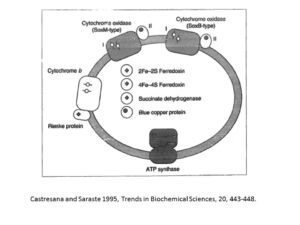
また、ビタミンCは水溶性で、状況によって酸素の吸収体としても供与体としても働くので、まざまな生化学反応にかかわっている。8つの酵素がビタミンCを補因子として要求するが、そのすべてが銅か鉄をその活性中心に持っている。これらの遷移金属は、ビタミンCから酸素原子を受け取り、それをアミノ酸に渡している。
細菌が体内に侵入すると、白血球の一種である中性顆粒球は、細菌を殺すためにフリーラジカルや次亜塩素酸のような酸化物質を爆発的に放出する。中性顆粒球は、その周りにビタミンCを集めて、自分が出す毒性物質から自分を守っている。
さらに、ビタミンCは動物の胃の中で、食物と中の難溶性のFe3+を可溶性のFe2+に変える働きがある。動物は、ビタミンCがないとヘモグロビンに蓄えるための鉄を確保できない。
一方、ビタミンCが、細胞質内で自由な(酵素の中に閉じ込められてない)鉄や銅などの遷移金属元素に出会って、酸素を渡してしまうとフェントン反応によるフリーラジカルの連鎖反応を開始してしまう。したがって、金属過剰の状況では、ビタミンCが毒になる可能性がある。実際、鉄の存在下でビタミンCを大量投入により腫瘍細胞やマラリア原虫が殺される例が報告されている。
Lane, N. 2002, Oxygen, The molecule that made the world, Oxford University Press, Oxford, chap 9 pp171-193.
書籍版『科学はひとつ』のご案内
戎崎俊一 著
学而図書/四六判 並製320頁/本体2,400円+税
12年にわたり執筆されてきた記事を精選し、「地震と津波防災」など全9章に再編。すべての章に著者書き下ろしの解説を加えて集成した一冊。